現代のPRP:「クリニカルPRP」
過去 10 年間で、PRP の治療スキームは大きく変わりました。実験研究と臨床研究を通じて、私たちは血小板やその他の細胞生理機能についてより深く理解できるようになりました。さらに、いくつかの質の高い体系的評価、メタ分析、ランダム化比較試験により、皮膚科、心臓外科、形成外科、整形外科、疼痛管理、脊椎疾患、スポーツ医学などの多くの医療分野における PRP バイオテクノロジーの有効性が示されています。 。
PRP の現在の特徴は絶対血小板濃度であり、これは PRP の初期定義 (ベースライン値より高い血小板濃度を含む) から 1 × 10 6/μ L 以上、つまり血小板の最小血小板濃度の約 5 倍に変化します。ベースライン。Fadadu らによる広範なレビューでは、33 の PRP システムとプロトコルが評価されました。これらのシステムの一部によって生成される最終 PRP 調製物の血小板数は、全血の血小板数よりも低くなります。彼らは、シングルスピンキット (Selphyl ®) を使用すると、PRP の血小板因子が 0.52 まで増加したと報告しました。対照的に、二重回転 EmCyte Genesis PurePRPII® デバイスによって生成される血小板濃度は最も高くなります (1.6 × 10 6 /μL)。
明らかに、インビトロ法や動物法は、臨床実践への転換を成功させるための理想的な研究環境ではありません。同様に、装置比較研究は、PRP 装置間の血小板濃度が大きく異なることを示しているため、この決定を裏付けません。幸いなことに、プロテオミクスに基づいた技術と分析を通じて、治療結果に影響を与える PRP の細胞機能についての理解を深めることができます。標準化された PRP 調製物および製剤についてのコンセンサスに達する前に、PRP は臨床 PRP 製剤に従って実質的な組織修復メカニズムと進歩的な臨床結果を促進する必要があります。
臨床PRP処方
現在、効果的な臨床 PRP (C-PRP) は、遠心分離後に末梢血の一部から得られた少量の血漿中の自己多細胞成分の複雑な組成として特徴付けられています。遠心分離後、PRP とその非血小板細胞成分は、さまざまな細胞密度 (血小板密度が最も低いもの) に応じて濃縮装置から回収できます。
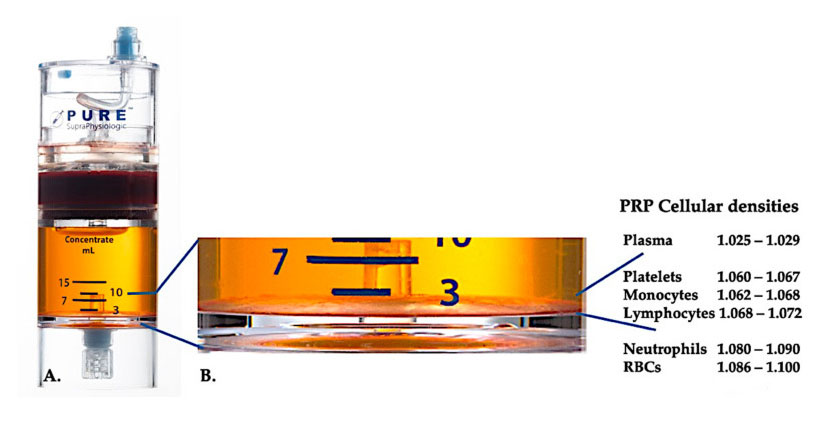
PurePRP-SP ® 細胞密度分離装置 (EmCyte Corporation、米国フロリダ州フォートマイヤーズ) を 2 回の遠心分離手順後の全血に使用しました。最初の遠心分離プロセスの後、全血成分は 2 つの基本層、血小板 (希薄) 血漿懸濁液と赤血球層に分離されました。A では、2 回目の遠心分離ステップが完了しています。実際の PRP 量は、患者に適用するために抽出できます。B の拡大図は、装置の底部に組織化された多成分赤血球沈降茶色層 (青線で表示) があることを示しています。密度勾配に基づいて、この層には高濃度の血小板、単球、リンパ球が含まれています。この例では、好中球が少ない場合の C-PRP 調製プロトコールに従って、最小割合の好中球 (<0.3%) と赤血球 (<0.1%) が抽出されます。
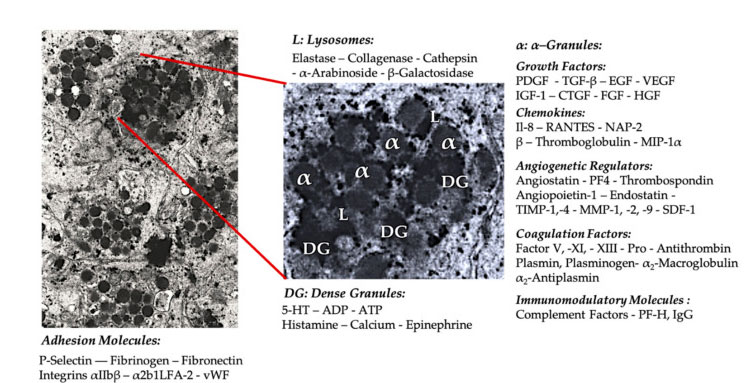
血小板顆粒
初期の臨床 PRP 応用では、α 顆粒が最も一般的に引用される血小板の内部構造です。これは、α 顆粒には凝固因子、多数の PDGF および血管新生調節因子が含まれていますが、血栓形成機能がほとんどないためです。他の因子には、血小板第 4 因子 (PF4)、血小板前塩基性タンパク質、P-セレクチン (インテグリンの活性化因子)、およびケモカイン RANTES (活性化によって調節され、正常な T 細胞を発現し、おそらく分泌している)。これらの特定の血小板顆粒成分の全体的な機能は、他の免疫細胞を動員して活性化するか、内皮細胞の炎症を誘導することです。
ADP、セロトニン、ポリリン酸、ヒスタミン、アドレナリンなどの高密度の顆粒成分は、より暗黙的に血小板活性化と血栓症の調節因子として使用されています。最も重要なことは、これらの元素の多くが免疫細胞を修飾する機能を持っていることです。血小板 ADP は樹状細胞 (DC) 上の P2Y12ADP 受容体によって認識され、抗原エンドサイトーシスを増加させます。DC (抗原提示細胞) は、T 細胞免疫応答の開始と、自然免疫系と獲得免疫系を結び付ける防御免疫応答の制御に非常に重要です。さらに、血小板アデノシン三リン酸 (ATP) は T 細胞受容体 P2X7 を介してシグナルを送り、CD4 T ヘルパー細胞の炎症誘発性 T ヘルパー 17 (Th17) 細胞への分化を促進します。他の血小板の高密度顆粒成分(グルタミン酸やセロトニンなど)は、それぞれ T 細胞の遊走を誘導し、単球の DC への分化を増加させます。PRP では、高密度粒子に由来するこれらの免疫調節物質が高度に濃縮されており、実質的な免疫機能を備えています。
血小板と他の(受容体)細胞との間の直接的および間接的な潜在的な相互作用の数は膨大です。したがって、局所的な病理学的組織環境に PRP を適用すると、さまざまな炎症効果が誘発される可能性があります。
血小板濃度
C-PRP には、有益な治療効果を生み出すために臨床用量の濃縮血小板が含まれている必要があります。図に示すように、C-PRP 内の血小板は細胞増殖、間葉および神経栄養因子の合成を刺激し、走化性細胞の遊走を促進し、免疫調節活性を刺激します。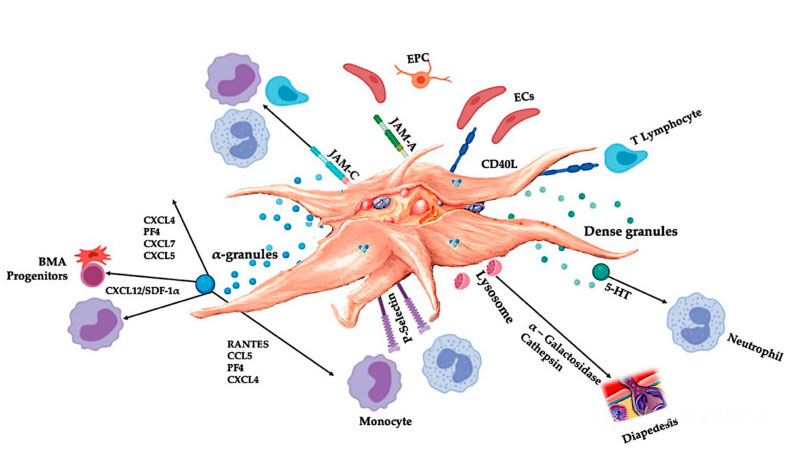
活性化された血小板、PGF および接着分子の放出は、走化性、細胞接着、遊走、細胞分化などのさまざまな細胞相互作用を媒介し、免疫調節活性を制御します。これらの血小板の細胞間相互作用は、血管新生と炎症活動に寄与し、最終的には組織修復プロセスを刺激します。略語: BMA: 骨髄穿刺液、EPC: 内皮前駆細胞、EC: 内皮細胞、5-HT: 5-ヒドロキシトリプタミン、RANTES: 正常 T 細胞発現および推定分泌の活性化制御、JAM: 結合接着分子タイプ、CD40L: クラスター40 リガンド、SDF-1 α:間質細胞由来因子-1 α、CXCL:ケモカイン(CXC モチーフ)リガンド、PF4:血小板因子 4。 Everts et al. より改変。
マルクスは、骨と軟組織の治癒が促進され、最小血小板数が 1 × 10 6 /μL であることを証明した最初の人物です。 これらの結果は、血小板の用量が1.3 × 106 血小板/μ L では、この研究ではより多くの融合が実証されました。さらに、Giusti ら。1.5 × 109 の用量での組織修復メカニズムは、内皮細胞の活性を通じて機能的な血管新生を誘導するために 1 mL あたりの血小板を必要とします。後者の研究では、濃度が高くなると、卵胞内およびその周囲の血小板の血管新生の可能性が低下しました。さらに、以前のデータでは、PRP の投与量も治療結果に影響を与えることが示されています。したがって、血管新生反応を顕著に誘導し、細胞増殖と細胞遊走を刺激するには、血小板を送達できる 5 mL PRP 治療ボトルに少なくとも 7.5 × 10 9 個の C-PRP が含まれている必要があります。
用量依存性に加えて、細胞活性に対する PRP の効果は時間依存性が高いと思われます。ソフィーら。これらの結果は、ヒト血小板溶解物への短期間の曝露が骨細胞の増殖と走化性を刺激する可能性があることを示唆しています。逆に、PRP に長期間さらされると、アルカリホスファターゼのレベルが低下し、ミネラル形成が低下します。
赤血球
赤血球は、酸素を組織に輸送し、二酸化炭素を組織から肺に輸送する役割を担っています。核はなく、タンパク質に結合するヘム分子で構成されています。赤血球内の鉄とヘム成分は、酸素と二酸化炭素の結合を促進します。一般に、赤血球のライフサイクルは約120日です。これらは、赤血球老化と呼ばれるプロセスを通じてマクロファージによって循環から除去されます。PRP サンプル中の赤血球は、せん断条件 (全血出血手術、免疫介在プロセス、酸化ストレス、または不適切な PRP 濃度スキームなど) の下で損傷する可能性があります。したがって、RBC 細胞膜は分解し、血漿遊離ヘモグロビン (PFH)、ヘム、鉄によって測定される有毒ヘモグロビン (Hb) を放出します。]PFH とその分解産物 (ヘムと鉄) は共同して組織に有害な細胞毒性効果をもたらし、酸化ストレス、一酸化窒素の損失、炎症経路の活性化、免疫抑制を引き起こします。これらの影響は、最終的に微小循環機能不全、局所的な血管収縮、血管損傷、さらには重篤な組織損傷を引き起こします。
最も重要なことは、C-PRPを含むRBCが組織に送達されると、赤血球症と呼ばれる局所反応を引き起こし、効果的なサイトカインおよびマクロファージ遊走阻害剤の放出を引き起こすことです。このサイトカインは、単球とマクロファージの移動を阻害します。周囲の組織に強力な炎症促進シグナルを発し、幹細胞の遊走と線維芽細胞の増殖を阻害し、重大な局所細胞機能不全を引き起こします。したがって、PRP 調製物中の RBC 汚染を制限することが重要です。さらに、組織再生における赤血球の役割はまだ解明されていません。適切な C-PRP 遠心分離と調製プロセスにより、通常、赤血球の存在が減少または排除され、溶血や赤血球増加症の悪影響が回避されます。
C-PRPの白血球
PRP 調製物中の白血球の存在は、治療装置と調製スキームによって異なります。血漿ベースの PRP 装置では、白血球は完全に除去されます。しかし、赤血球沈降褐色層の PRP 調製物では白血球が著しく濃縮されていました。白血球は、その免疫および宿主防御機構により、急性および慢性の組織状態の内部生物学に大きな影響を与えます。これらの機能については、以下でさらに説明します。したがって、C-PRP に特定の白血球が存在すると、細胞および組織に重大な影響を与える可能性があります。より具体的には、異なる PRP 赤血球沈降黄褐色層系では異なる調製スキームが使用されるため、PRP 内で異なる割合の好中球、リンパ球、単球が生成されます。好酸球と好塩基球は、細胞膜が遠心処理力に耐えられないほど脆弱であるため、PRP 調製物では測定できません。
好中球
好中球は、多くの治癒経路において不可欠な白血球です。これらの経路は、血小板に存在する抗菌タンパク質と結合して、侵入性病原体に対する緻密な障壁を形成します。C-PRPの治療対象に応じて好中球の存在が判定されます。慢性創傷ケアの PRP 生物療法や、骨の成長や治癒を目的とした用途では、組織炎症レベルの増加が必要になる場合があります。重要なのは、追加の好中球機能がいくつかのモデルで発見されており、血管新生と組織修復における好中球の役割が強調されていることです。ただし、好中球は有害な影響を引き起こす可能性もあるため、一部の用途には適していません。Zhou と Wang は、好中球が豊富な PRP を使用すると、I 型コラーゲンに対する III 型コラーゲンの比率が増加し、線維症が悪化して腱の強度が低下する可能性があることを証明しました。好中球が媒介する他の有害な特性としては、炎症性サイトカインやマトリックスメタロプロテイナーゼ (MMP) の放出があり、これらが組織に適用されると炎症や異化を促進する可能性があります。
白血球
C-PRP では、単核 T および B リンパ球が他の白血球よりも濃縮されています。それらは細胞媒介細胞傷害性適応免疫と密接に関連しています。リンパ球は、感染と闘い、侵入者に適応するための細胞反応を引き起こすことができます。さらに、T リンパ球由来のサイトカイン (インターフェロン-γ [IFN-γ] およびインターロイキン-4 (IL-4) は、マクロファージの極性化を促進します。Verassar らによると、従来の T リンパ球は間接的に組織治癒を促進できることが証明されています)。単球とマクロファージの分化を制御することによるマウスモデル。
単球 – 多能性修復細胞
使用するPRP調製装置によっては、PRP処理ボトル内に単球がはみ出す場合や存在しない場合があります。残念なことに、それらの性能と再生能力は文献でほとんど議論されていません。したがって、調製方法や最終配合では単球にはほとんど注意が払われません。単球群は不均一であり、骨髄の前駆細胞に由来し、微小環境の刺激に応じて造血幹細胞経路を介して末梢組織に輸送されます。恒常性と炎症の間、循環する単球は血流を離れ、損傷または劣化した組織に補充されます。それらはマクロファージ (M Φ) エフェクター細胞または前駆細胞として機能します。単球、マクロファージ、および樹状細胞は、単核食細胞系 (MPS) を表します。MPS の典型的な特徴は、その遺伝子発現パターンの可塑性と、これらの細胞型間の機能的重複です。変性組織では、常在マクロファージ、局所的に作用する成長因子、炎症促進性サイトカイン、アポトーシスまたは壊死細胞、および微生物産物が単球の MPS 細胞群への分化を開始します。高収量の単球を含む C-PRP を疾患の局所微環境に注射すると、単球が M Φ に分化して大きな細胞変化を引き起こす可能性が高いと仮定します。
単球から M Φ への変換の過程で、特定の M Φ 表現型。過去 10 年間で、M Φ を統合したモデルが開発されました。活性化の複雑なメカニズムは、M Φ 表現型 1 (M Φ 1、古典的な活性化) と M Φ 表現型 2 (M Φ 2、代替アクティベーション)。M Φ 1 は、炎症性サイトカイン (IFN-γ) と一酸化窒素の分泌によって特徴付けられ、効果的な病原体死滅機構を生み出します。M Φ この表現型は、血管内皮増殖因子 (VEGF) および線維芽細胞増殖因子 (FGF) も生成します。M Φ 表現型は、高い貪食作用を持つ抗炎症細胞で構成されます。M Φ 2 細胞外マトリックス成分、血管新生とケモカイン、およびインターロイキン 10 (IL-10) を生成します。病原体防御に加えて、M Φ 炎症を軽減し、組織修復を促進することもできます。M Φ 2 が M in vitro Φ 2a、M Φ 2b、M Φ 2 に細分化されていることは注目に値します。それは刺激に依存します。組織には混合した M Φ グループが含まれる可能性があるため、これらのサブタイプの in vivo 翻訳は困難です。興味深いことに、局所的な環境シグナルと IL-4 レベルに基づいて、炎症誘発性 M Φ 1 が修復を促進する M Φ 2 に変換される可能性があります。 これらのデータから、高濃度の単球と M Φ C-PRP 調製物が存在すると仮定するのが合理的です。これらは抗炎症性の組織修復能力と細胞シグナル伝達能力を持っているため、より良い組織修復に貢献すると考えられます。
PRP における白血球分画の定義が混乱している
PRP 処理ボトル内の白血球の存在は PRP 調製装置によって異なり、大きな違いがある場合があります。白血球の存在と、さまざまなサブ PRP 製品 (PRGF、P-PRP、LP-PRP、LR-PRP、P-PRF、L-PRF など) への白血球の寄与については多くの論争があります。最近のレビューでは、6 つのランダム化された1,055 人の患者を対象とした対照試験 (証拠レベル 1) と 3 件の前向き比較研究 (証拠レベル 2) では、LR-PRP と LP-PRP が同様の安全性を有することが示されました。著者は、PRPの副作用は白血球濃度に直接関係しない可能性があると結論付けました。別の研究では、LR-PRP は OA 膝 β、IL-6、IL-8、IL-17 の炎症性インターロイキン (IL-1) を変化させませんでした。これらの結果は、生体内での PRP の生物学的活性における白血球の役割は、血小板と白血球の間のクロストークに由来する可能性があるという見解を裏付けています。この相互作用は他の因子 (リポキシゲンなど) の生合成を促進する可能性があり、炎症を相殺または炎症の退行を促進する可能性があります。炎症性分子 (アラキドン酸、ロイコトリエン、プロスタグランジン) が最初に放出された後、好中球の活性化を防ぐために活性化された血小板からリポキシゲン A4 が放出されます。この環境において、M Φ 表現型は M Φ 1 から M Φ 2 に切り替わります。 さらに、循環単核細胞が多能性によりさまざまな非食細胞型に分化できるという証拠が増えています。
PRP の種類は MSC 培養に影響します。純粋な PRP または PPP サンプルと比較して、LR-PRP は、放出が速く、PGF 生物学的活性が優れているため、骨髄由来 MSC (BMMSC) の大幅に高い増殖を誘導できます。これらすべての特性は、単球を PRP 治療ボトルに追加し、その免疫調節能力と分化能を認識するのに役立ちます。
PRPの先天性および適応免疫制御
血小板の最も有名な生理学的機能は、出血を制御することです。それらは組織損傷部位と損傷した血管に蓄積します。これらの現象は、血小板の接着と凝集を刺激するインテグリンとセレクチンの発現によって引き起こされます。損傷した内皮はこのプロセスをさらに悪化させ、露出したコラーゲンや他の内皮下マトリックスタンパク質は血小板の深い活性化を促進します。これらの場合、フォン ヴィレブランド因子 (vWF) と糖タンパク質 (GP)、特に GP-Ib の間の相互作用の重要な役割が証明されています。血小板の活性化後、血小板α、高密度、リソソームおよびT顆粒がエキソサイトーシスを調節し、その内容物を細胞外環境に放出します。
血小板接着分子
炎症組織における PRP の役割と免疫応答における血小板の役割をより深く理解するには、さまざまな血小板表面受容体 (インテグリン) と結合接着分子 (JAM) および細胞相互作用がどのようにして自然免疫および適応免疫における重要なプロセスを開始できるかを理解する必要があります。
インテグリンは、さまざまな種類の細胞に見られる細胞表面接着分子であり、血小板上に大量に発現されます。インテグリンには、a5b1、a6b1、a2b1 LFA-2 (GPIa/IIa) および aIIbb3 (GPIIb/IIIa) が含まれます。通常、それらは静的で親和性の低い状態で存在します。活性化後、リガンド結合親和性が高い状態に切り替わります。インテグリンは血小板に対してさまざまな機能を持ち、血小板と数種類の白血球、内皮細胞および細胞外マトリックスとの相互作用に関与します。さらに、GP-Ib-V-IX 複合体は血小板膜上に発現し、von vWF と結合するための主要な受容体です。この相互作用は、血小板と露出した内皮下構造の間の最初の接触を媒介します。血小板インテグリンと GP 複合体はさまざまな炎症プロセスに関連しており、血小板-白血球複合体の形成において重要な役割を果たしています。具体的には、インテグリン aIIbb3 は、フィブリノーゲンと好中球上のマクロファージ 1 抗原 (Mac-1) 受容体を結合させて安定な複合体を形成するために必要です。
血小板、好中球、血管内皮細胞は、セレクチンと呼ばれる特定の細胞接着分子を発現します。炎症状態下では、血小板は P-セレクチンと好中球 L-セレクチンを発現します。血小板の活性化後、P-セレクチンは好中球および単球上に存在するリガンド PSGL-1 に結合する可能性があります。さらに、PSGL-1 の結合により細胞内シグナルカスケード反応が開始され、好中球インテグリン Mac-1 およびリンパ球機能関連抗原 1 (LFA-1) を介して好中球が活性化されます。活性化された Mac-1 は、フィブリノーゲンを介して血小板上の GPIb または GPIIb/IIIa に結合し、好中球と血小板間の相互作用を安定化します。さらに、活性化されたLFA-1は血小板細胞間接着分子2と結合して好中球-血小板複合体をさらに安定化し、細胞との長期接着を促進します。
血小板と白血球は自然免疫応答と適応免疫応答において重要な役割を果たします
体は、急性または慢性疾患における異物や損傷組織を認識して、創傷治癒カスケード反応および炎症経路を開始することができます。自然免疫系と適応免疫系は宿主を感染から守り、白血球は 2 つの系の間で重なり合う重要な役割を果たします。具体的には、単球、マクロファージ、好中球、ナチュラルキラー細胞が自然系で重要な役割を果たし、リンパ球とそのサブセットが獲得免疫系でも同様の役割を果たします。
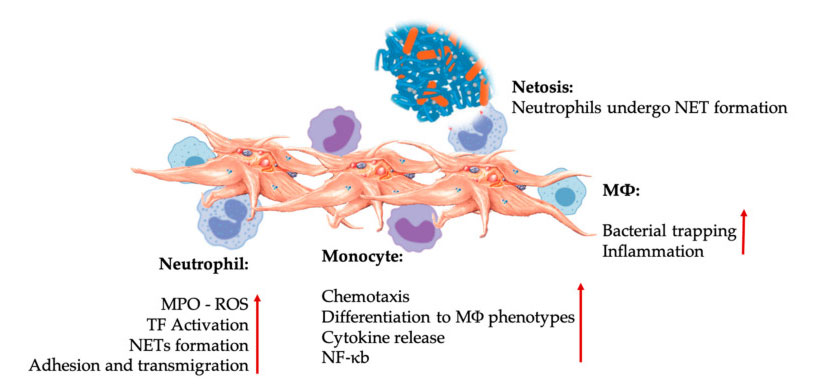
自然免疫細胞相互作用における血小板と白血球の相互作用。血小板は好中球および単球と相互作用し、最後に M Φ と相互作用して、それらのエフェクター機能を調整および増加します。これらの血小板と白血球の相互作用は、NETosis などのさまざまなメカニズムを通じて炎症を引き起こします。略語:MPO:ミエロペルオキシダーゼ、ROS:活性酸素種、TF:組織因子、NET:好中球細胞外トラップ、NF-κB:核因子κB、MΦ:マクロファージ。
自然免疫システム
自然免疫系の役割は、侵入微生物や組織断片を非特異的に識別し、それらの除去を刺激することです。表面発現パターン認識受容体 (PRR) と呼ばれる特定の分子構造が、病原体関連の分子パターンおよび損傷関連の分子パターンと結合すると、自然免疫系が活性化されます。PRR には、Toll 様受容体 (TLR) や RIG-1 様受容体 (RLR) など、多くの種類があります。これらの受容体は、主要な転写因子カッパ B (NF-κ B) を活性化することができます。また、自然免疫応答および適応免疫応答の複数の側面も調節します。興味深いことに、血小板は、その表面および細胞質上に、P-セレクチン、膜貫通タンパク質CD40リガンド(CD40L)、サイトカイン(IL-1 β、TGF-βなど)、血小板特異的TLRなどのさまざまな免疫調節受容体分子も発現しています。 . したがって、血小板はさまざまな免疫細胞と相互作用することができます。
自然免疫における血小板と白血球の相互作用
血小板が血流や組織に進入または侵入するとき、血小板は内皮損傷や微生物病原体を最初に検出する細胞の 1 つです。血小板が凝集し、血小板アゴニストである ADP、トロンビン、vWF の放出が促進され、その結果、血小板の活性化と血小板ケモカイン受容体 C、CC、CXC、CX3C の発現が引き起こされ、感染部位または傷害に血小板が発生します。
自然免疫系は、ウイルス、細菌、寄生虫、毒素などの侵入者、または組織の傷や創傷を検出するように遺伝的にあらかじめ設定されています。これは、あらゆる病原体が外来または非自己であると識別され、迅速に特定されるため、非特異的なシステムです。自然免疫系は、宿主が特定の病原体に一度も曝露されたことがない場合でも、病原体のよく保存された特性を認識し、侵入者の排除を助けるために免疫応答を迅速に活性化する一連のタンパク質と食細胞に依存しています。
好中球、単球、樹状細胞は、血液中で最も一般的な自然免疫細胞です。適切な初期免疫反応には、それらの動員が必要です。PRP が再生医療に使用される場合、血小板と白血球の相互作用が炎症、創傷治癒、組織修復を制御します。血小板上のTLR-4は血小板と好中球の相互作用を刺激し、好中球からの活性酸素種(ROS)とミエロペルオキシダーゼ(MPO)の放出を調節することによって、いわゆる白血球の酸化バーストを調節します。さらに、血小板と好中球の相互作用と好中球の脱顆粒により、好中球細胞外トラップ (NET) が形成されます。NET は、好中球核とその他の好中球細胞内内容物で構成されており、細菌を捕捉し、NETosis を通じて細菌を殺すことができます。NET の形成は、好中球の必須の死滅メカニズムです。
血小板の活性化後、単球は罹患した変性組織に移動することができ、そこで接着活動を実行し、走化性やタンパク質分解特性を変化させる可能性のある炎症性分子を分泌します。さらに、血小板は単球の NF-κ B 活性化を誘導して、炎症反応および免疫細胞の活性化と分化の重要なメディエーターである単球のエフェクター機能を調節します。血小板はさらに、単球の内因性酸化バーストを促進して、食作用性病原体の破壊を促進します。MPO の放出は、血小板 - 単球 CD40L-MAC-1 間の直接相互作用によって媒介されます。興味深いことに、P-セレクチンが急性および慢性の炎症組織状態下で血小板を活性化すると、血小板由来ケモカインPF4、RANTES、IL-1βおよびCXCL-12は単球の自然発生的なアポトーシスを防ぐことができますが、マクロファージへの分化を促進します。
適応免疫システム
非特異的自然免疫系が微生物または組織の損傷を認識した後、特異的適応免疫系が引き継ぎます。適応システムには、病原体の除去を調整する抗原結合 B リンパ球 (B 細胞) と従来の T リンパ球 (Treg) が含まれます。T細胞は、ヘルパーT細胞(Th細胞)と細胞傷害性T細胞(Tc細胞、Tキラー細胞とも呼ばれる)に大別できます。Th 細胞はさらに Th1、Th2、および Th17 細胞に分類され、炎症において重要な機能を果たします。Th 細胞は、炎症誘発性サイトカイン (例: IFN-γ、TNF-β) およびいくつかのインターロイキン (例: IL-17) を分泌できます。これらは、細胞内ウイルスや細菌感染の予防に特に効果的です。Th 細胞は、炎症に関与する細胞の増殖と分化を刺激します。免疫応答 Tc 細胞は、標的の細胞内および細胞外の微生物および細胞を排除できるエフェクター細胞です。
興味深いことに、Th2 細胞は IL-4 を産生し、M Φ 分極、M Φ 誘導再生 M Φ 2 表現型に影響を与える一方、IFN-γ M Φ はサイトカインの用量と時間に依存して炎症性 M Φ 1 表現型に変化します。IL-4 が活性化された後、M Φ 2 は Treg 細胞の Th2 細胞への分化を誘導し、さらに IL-4 を産生します (正のフィードバック ループ)。Th 細胞は M Φ を変換します。表現型は、組織由来の生物学的因子に応答して再生表現型に向けられます。このメカニズムは、Th 細胞が炎症と組織修復の制御に重要な役割を果たしているという証拠に基づいています。
獲得免疫における血小板と白血球の相互作用
適応免疫システムは、抗原特異的受容体を使用し、以前に遭遇した病原体を記憶し、その後宿主に遭遇したときにそれらを破壊します。しかし、これらの適応免疫反応はゆっくりと発現しました。コニアスら。これは、血小板成分がリスク認識と組織修復に寄与し、血小板と白血球間の相互作用が適応免疫応答の活性化を促進することを示しています。
適応免疫応答中、血小板は DC 細胞と NK 細胞の成熟を通じて単球とマクロファージの応答を促進し、特異的な T 細胞と B 細胞の応答を引き起こします。したがって、血小板顆粒成分は、獲得免疫応答の調節に不可欠な分子である CD40L を発現することにより、獲得免疫に直接影響を与えます。CD40L を介した血小板は、抗原提示において役割を果たすだけでなく、T 細胞反応にも影響を与えます。劉ら。血小板が CD4 T 細胞応答を複雑な方法で調節していることが判明しました。CD4 T 細胞サブセットのこの異なる制御は、血小板が CD4 T 細胞の炎症性刺激への応答を促進し、強力な炎症誘発性および抗炎症性反応を引き起こすことを意味します。
血小板はまた、微生物病原体に対する B 細胞媒介の適応反応も調節します。活性化された CD4 T 細胞上の CD40L が B 細胞の CD40 を誘発し、T 細胞依存性 B リンパ球の活性化、その後のアロタイプ変換、および B 細胞の分化と増殖に必要な 2 番目のシグナルを提供することはよく知られています。一般に、結果は適応免疫における血小板のさまざまな機能を明確に示しており、血小板が CD40-CD40L を介して T 細胞と B 細胞の間の相互作用を結び付け、したがって T 細胞依存性の B 細胞応答を増強することを示しています。さらに、血小板には細胞表面受容体が豊富に含まれており、これにより血小板の活性化が促進され、さまざまな血小板粒子に保存されている多数の炎症性分子や生物学的活性分子が放出され、自然免疫応答および適応免疫応答に影響を与える可能性があります。
PRPにおける血小板由来セロトニンの役割の拡大
セロトニン (5-ヒドロキシトリプタミン、5-HT) は、疼痛耐性を含む中枢神経系 (CNS) において明らかに重要な役割を果たしています。ヒトの 5-HT の大部分は胃腸管で生成され、その後血液循環を介してセロトニン再取り込みトランスポーターを介して血小板に吸収され、高濃度 (65 mmol/L) で高密度粒子として保存されると推定されています。5-HT は、CNS (中枢 5-HT) におけるさまざまな神経心理学的プロセスの調節に役立つよく知られた神経伝達物質およびホルモンです。しかし、5-HT のほとんどは CNS の外側 (末梢 5-HT) に存在し、心血管、肺、胃腸、泌尿器、血小板の機能系を含む複数の臓器系の全身および細胞の生物学的機能の調節に関与しています。5-HT は、脂肪細胞、上皮細胞、白血球などのさまざまな種類の細胞に対して濃度依存的な代謝を行います。末梢 5-HT は強力な免疫調節因子でもあり、炎症を刺激または阻害し、その特異的な 5-HT 受容体 (5HTR) を介してさまざまな免疫細胞に影響を与えることができます。
HT のパラクリンおよびオートクリン機構
5-HT の活性は、5HTR との相互作用によって媒介されます。5HTR は、7 つのメンバー (5-HT 1 ~ 7) と、最近発見されたメンバー 5-HT 7、その末梢および受容体サブタイプを含む少なくとも 14 の異なる受容体サブタイプからなるスーパーファミリーです。痛みの管理に機能します。血小板脱顆粒の過程で、活性化された血小板は血小板由来の 5-HT を大量に分泌します。これにより、血管収縮が促進され、内皮細胞、平滑筋細胞、細胞上での 5-HTR の発現を通じて隣接する血小板およびリンパ球の活性化が刺激されます。免疫細胞。パカラら。血管内皮細胞に対する 5-HT の有糸分裂効果が研究され、血管新生を刺激することによって損傷した血管の成長を促進する可能性が確認されました。これらのプロセスがどのように調節されるのかは完全には明らかではありませんが、血管内皮細胞、平滑筋細胞、線維芽細胞、免疫細胞の機能を、これらの細胞上の特異的な 5-HT 受容体を介して調節するために、組織微小回路における差動双方向シグナル経路が関与している可能性があります。 。血小板活性化後の血小板 5-HT の自己分泌機能については記載されています [参考文献]。5-HT の放出は、血小板の活性化と循環血小板の動員を強化し、シグナルカスケード反応と血小板の反応性をサポートする上流エフェクターの活性化につながります。
免疫調節性 5-HT 効果
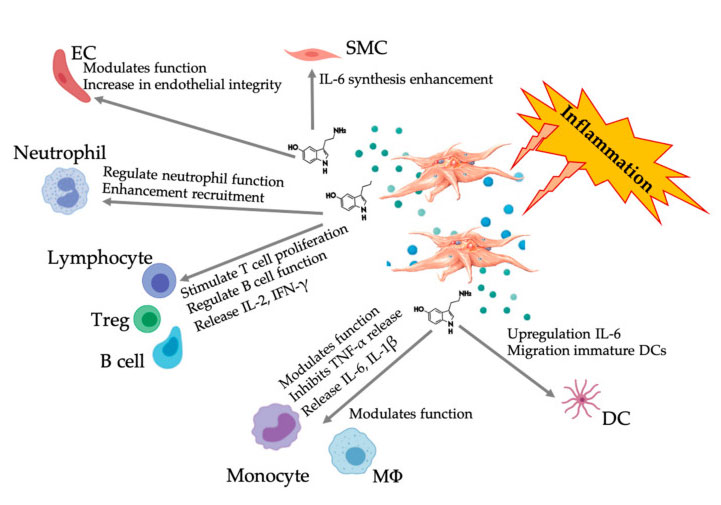
セロトニンがさまざまな 5HTR において免疫調節因子として役割を果たす可能性があることを示す証拠が増えています。炎症反応に関与するさまざまな白血球で発現される 5HTR によると、血小板由来 5-HT は自然免疫系と獲得免疫系の両方で免疫調節因子として機能します。5-HT は、DC および単球を炎症部位に動員することにより、Treg の増殖を刺激し、B 細胞、ナチュラルキラー細胞および好中球の機能を調節します。最近の研究では、血小板由来 5-HT が特定の条件下で免疫細胞の機能を調節できることが示されています。したがって、C-PRP を使用すると、血小板濃度が 1 × 10 6/μ L を超えると、大きな血小板に由来する 5-HT 濃度を組織に輸送するのに大きく役立ちます。炎症成分によって特徴付けられる微小環境では、PRP はこれらの病態で重要な役割を果たすいくつかの免疫細胞と相互作用する可能性があり、臨床結果に影響を与える可能性があります。
炎症性 PRP 血小板の活性化後の多面的な 5-HT 応答を示す図。血小板の活性化後、血小板は、高密度顆粒中の 5-HT を含む顆粒を放出します。これは、さまざまな免疫細胞、内皮細胞、平滑筋細胞に対して広範囲にわたる異なる影響を及ぼします。略語: SMC: 平滑筋細胞、EC: 内皮細胞、Treg: 従来の T リンパ球、M Φ: マクロファージ、DC: 樹状細胞、IL: インターロイキン、IFN-γ: インターフェロン γ。およびハルら。
PRPの鎮痛効果
活性化された血小板は多くの炎症促進性および抗炎症性メディエーターを放出し、痛みを引き起こすだけでなく、炎症や痛みを軽減することもできます。PRP の典型的な血小板動態は、適用されると、同化作用と異化作用、細胞増殖、分化、幹細胞制御に関連するさまざまな複雑な経路を介して組織の修復と再生の前に微小環境を変化させます。PRP のこれらの特徴は、正確なメカニズムは完全には解明されていませんが、通常は慢性疼痛を伴うさまざまな臨床病理学的状態 (スポーツ傷害、整形外科疾患、脊椎疾患、複雑な慢性創傷など) への PRP の適用につながります。
2008 年に、Evertz らは肩術後の自己赤血球沈降速度の褐色層から調製し、自己トロンビンで活性化したPRP製剤の鎮痛効果を報告した初めてのランダム化比較試験である。彼らは、視覚アナログスケールスコアの大幅な減少、オピオイドベースの鎮痛薬の使用、および術後のリハビリテーションのより成功したことに注目しました。彼らが活性化血小板の鎮痛効果を反映し、血小板が5-HTを放出するメカニズムを推測していることは注目に値する。つまり、血小板は、新たに調製された PRP 中では休眠状態になっています。血小板が直接的または間接的に(組織因子)活性化された後、血小板は形状を変化させ、血小板の凝集を促進するのに十分な量の血小板を生成します。次に、細胞内にα-および高密度粒子を放出します。活性化された PRP で処理された組織は、PGF、サイトカイン、その他の血小板リソソームによって侵入されます。具体的には、高密度粒子が内容物を放出すると、痛みを調節する5-HTが大量に放出されます。C-PRP では、血小板濃度が末梢血の血小板濃度の 5 ~ 7 倍高くなります。したがって、血小板からの 5-HT の放出は天文学的な量になります。興味深いことに、Sprott et al.この報告では、鍼灸治療後に痛みが大幅に軽減され、血小板由来の 5-HT 濃度が大幅に低下し、その後、血漿 5-HT レベルが増加したことが観察されました。
末梢では、組織損傷または外科的外傷の際に、血小板、マスト細胞および内皮細胞が内因性 5-HT を放出します。興味深いことに、ニューロンのさまざまな 5-HT 受容体が末梢領域で検出され、5-HT が末梢領域の侵害受容伝達を妨害できることが確認されました。これらの研究は、5-HT が 5-HT1、5-HT2、5-HT3、5-HT4、および 5-HT7 受容体を介して末梢組織の侵害受容伝達に影響を与える可能性があることを示しています。
5-HT システムは、有害な刺激後の痛みの程度を軽減または増加できる強力なシステムを表します。慢性疼痛患者では、侵害受容シグナルの中枢および末梢の調節と 5-HT システムの変化が報告されています。近年、有害情報の処理と制御における 5-HT とそのそれぞれの受容体の役割に多くの研究が焦点を当てており、その結果、選択的セロトニン再取り込み阻害剤 (SSRI) などの薬剤が開発されています。この薬は、セロトニン放出後のシナプス前ニューロンへのセロトニンの再取り込みを阻害します。これはセロトニン伝達の持続時間と強度に影響を与え、慢性疼痛の代替治療法です。慢性疾患および変性疾患における PRP 由来の 5-HT 疼痛調節の分子機構を明確に理解するには、さらなる臨床研究が必要です。
PRP の潜在的な鎮痛効果を解明するための他のデータは、鎮痛動物モデル試験後に得ることができます。これらの研究には変数が多すぎるため、これらのモデルの比較統計的結論は困難です。それにもかかわらず、いくつかの臨床研究では PRP の侵害受容および鎮痛効果に取り組んでいます。腱鞘炎や腱板断裂の治療を受けている患者には痛みがほとんど軽減されないことが、いくつかの研究で示されています。対照的に、他のいくつかの研究では、PRP が腱変性、OA、足底筋膜炎、その他の足や足首の疾患を持つ患者の痛みを軽減、または除去できることが示されています。最終的な血小板濃度と生体細胞組成は PRP の重要な特性として特定されており、PRP 適用後の一貫した鎮痛効果を観察するのに役立ちます。他の変数には、PRP 送達方法、適用技術、血小板活性化プロトコル、PGF および放出されるサイトカインの生物活性レベル、PRP 適用の組織タイプ、損傷タイプが含まれます。
クフラー博士が、損傷した非再生神経に続発する軽度から重度の慢性神経障害性疼痛患者の疼痛緩和におけるPRPの可能性を解決したことは注目に値する。この研究の目的は、軸索再生と標的神経再支配を促進する PRP により神経障害性疼痛が軽減または鎮静できるかどうかを調査することです。驚くべきことに、治療を受けている患者の間では、手術後少なくとも 6 年たっても神経因性疼痛が解消または軽減されています。さらに、すべての患者は PRP 適用後 3 週間以内に痛みを軽減し始めました。
最近、同様の鎮痛 PRP 効果が術後の傷やスキンケアの分野でも観察されています。興味深いことに、著者らは、血管損傷および皮膚組織の低酸素症に関連する創傷の痛みの生理学的側面を報告しました。彼らはまた、酸素供給と栄養送達の最適化における血管新生の重要性についても議論しました。彼らの研究は、対照群と比較して、PRP治療を受けている患者は痛みが少なく、血管新生が有意に増加していることを示しました。最後に、Johal らは系統的レビューとメタ分析を実施し、整形外科の適応症、特に外上顆炎や膝 OA 治療を受けている患者において PRP を使用した後の痛みを軽減できると結論付けました。残念ながら、この研究では、白血球、血小板濃度、または外因性血小板活性化因子の使用の影響は特定されていませんでした。これらの変数は PRP の全体的な有効性に影響を与えるためです。痛みを最大限に軽減するための最適な PRP 血小板濃度は不明です。腱鞘炎のラットモデルでは、血小板濃度は 1.0 × 10 6 /μL で、痛みは完全に軽減できますが、血小板濃度が半分の PRP による痛みの軽減は大幅に減少します。したがって、さまざまな PRP 製剤の鎮痛効果を調査する臨床研究をさらに奨励します。
PRPと血管新生効果
精密な再生医療における C-PRP 製剤は、標的組織部位で活性化された高濃度の血小板によって放出される生体分子の送達を可能にします。したがって、さまざまなカスケード反応が開始され、その場での免疫調節、炎症プロセス、および血管新生に寄与して、治癒と組織修復を促進します。
血管新生は、発芽と既存の血管からの組織微小血管を含む動的な複数段階のプロセスです。血管新生は、内皮細胞の遊走、増殖、分化、分裂などのさまざまな生物学的メカニズムによって進行してきました。これらの細胞プロセスは、新しい血管の形成の前提条件です。これらは、血流を回復し、組織修復と組織再生の高い代謝活動をサポートするために既存の血管の成長に不可欠です。これらの新しい血管により、酸素と栄養素の輸送と、治療された組織からの副産物の除去が可能になります。
血管新生活性は、血管新生因子 VEGF および抗血管新生因子 (アンジオスタチンやトロンボスポンジン 1 [TSP-1] など) を刺激することによって制御されます。病的で劣化した微環境(低酸素分圧、低pH、高乳酸レベルなど)では、局所の血管新生因子が血管新生活性を回復します。
基本的な FGF、TGF-β、VEGF などのいくつかの血小板可溶性培地は、内皮細胞を刺激して新しい血管を生成します。Landsdown と Fortier は、多くの血管新生調節因子の血小板内供給源を含む、PRP 組成に関連するさまざまな結果を報告しました。さらに、血管新生の増加は、半月板断裂、腱損傷、その他の血管新生が不十分な領域などの血管新生が不十分な領域におけるMSK疾患の治癒に寄与すると結論付けています。
血小板の血管新生阻害特性の促進
過去数十年間に発表された研究により、血小板が一次止血、血栓形成、成長因子とサイトカイン放出、および組織修復プロセスの一部としての血管新生制御において重要な役割を果たしていることが証明されてきました。逆説的ですが、PRP α - 顆粒には血管新生促進因子、抗血管新生タンパク質、サイトカイン (PF4、プラスミノーゲン アクチベーター阻害剤-1、TSP-1 など) が豊富に含まれており、役割を果たす特定の因子の放出を標的とします。 。血管新生における役割。したがって、血管新生制御の制御における PRP の役割は、特定の細胞表面受容体である TGF-β の活性化によって定義される可能性があります。血管新生促進反応および抗血管新生反応を開始します。血小板が血管新生経路を実行する能力は、病理学的血管新生および腫瘍血管新生において確認されています。
血小板由来の血管新生増殖因子および抗血管新生増殖因子は、α- および緻密で接着性の分子に由来します。最も重要なことは、血管新生に対する血小板の全体的な効果は血管新生を促進し、刺激するものであることが一般に受け入れられているということです。PRP療法は血管新生の誘導を制御し、創傷治癒や組織修復など多くの疾患の治療効果に貢献すると期待されています。PRPの投与、より具体的には高濃度のPGFおよび他の血小板サイトカインの投与は、間質細胞由来の因子1aが内皮前駆細胞上のCXCR4受容体に結合するため、血管新生、脈管形成および動脈形成を誘導することができる。ビルら。PRP は虚血性血管新生を増加させることが示唆されていますが、これは血管新生、新脈管形成、動脈新生の刺激によるものである可能性があります。彼らの in vitro モデルでは、内皮細胞の増殖と毛細血管の形成が多数の異なる PDG によって誘導され、そのうちの VEGF が主な血管新生刺激因子でした。血管新生経路を回復するためのもう 1 つの重要かつ不可欠な要素は、複数の PGF 間の相乗効果です。リチャードソンら。血管新生因子である血小板由来増殖因子-bb (PDGF-BB) と VEGF の相乗作用により、個々の増殖因子の活性に比べて成熟血管ネットワークが迅速に形成されることが証明されました。これらの因子の複合効果は、長期にわたる低灌流状態のマウスにおける脳側副血行促進に関する研究で最近確認されました。
最も重要なことは、in vitro 研究で、PRP 調製デバイスと血小板投与戦略の選択に対するヒト臍帯静脈内皮細胞の増殖効果とさまざまな血小板濃度が測定され、その結果、最適な血小板投与量は 1.5 × 10 6 血小板/μであることが示されました。 50. 血管新生を促進する。血小板濃度が高すぎると血管新生プロセスが阻害される可能性があるため、効果が不十分になります。
細胞の老化、老化とPRP
細胞老化はさまざまな刺激によって引き起こされます。これは、細胞が分裂を停止し、損傷を受けた細胞が無制限に増殖するのを防ぐために独特の表現型変化を起こすプロセスであり、がんの予防に重要な役割を果たします。生理的老化の過程では、細胞複製老化も細胞の老化を促進し、間葉系幹細胞の再生能力が低下します。
老化と細胞老化の影響
生体内では、多くの細胞タイプが老化し、老化中にさまざまな組織に蓄積しますが、その中には多数の老化細胞が存在します。老化細胞の蓄積は、年齢、免疫系の損傷、組織の損傷、またはストレス関連要因の増加とともに増加すると考えられます。細胞老化のメカニズムは、変形性関節症、骨粗鬆症、椎間板変性などの加齢関連疾患の病原因子として特定されています。さまざまな刺激が細胞の老化を悪化させます。これに応答して、老化関連分泌表現型 (SASP) は高濃度のタンパク質細胞とサイトカインを分泌します。この特殊な表現型は細胞の老化に関連しており、細胞は高レベルの炎症性サイトカイン (IL-1、IL-6、IL-8 など)、成長因子 (TGF-β、HGF、VEGF、PDGF など)、 MMP、カテプシン。若者と比較して、SAPSは年齢とともに増加することが証明されています。これは、定常状態のプロセスが破壊され、細胞が老化し、再生能力が低下するためです。具体的には、関節疾患と骨格筋疾患です。これに関して、免疫老化は免疫細胞の分泌スペクトルの重大な変化であると考えられており、TNF-α、IL-6、および/または Il-1b の濃度が増加し、軽度の慢性炎症を引き起こすことを示しています。幹細胞の機能不全は、細胞の老化、特にSASPを介した炎症促進因子や抗再生因子の産生などの非細胞自律メカニズムにも関連していることは注目に値します。
逆に、SASP は細胞の可塑性や隣接する細胞の再プログラミングも刺激します。さらに、SASP はさまざまな免疫メディエーターとのコミュニケーションを組織化し、免疫細胞を活性化して老化細胞の除去を促進します。老化細胞の役割と機能を理解することは、MSK 筋肉や慢性創傷の治癒と組織再構築に貢献します。
Ritcka et al.広範な研究が実施され、細胞可塑性と組織再生の促進における SASP の主で有益な役割が発見され、老化細胞の一時的な治療送達の概念が導入されました。彼らは、老化は主に有益で再生的なプロセスであると慎重に述べました。
細胞の老化とPRPの可能性
幹細胞の数が減少すると、老化は幹細胞のパフォーマンスに影響を与えます。同様に、ヒトでも幹細胞の特性(乾燥、増殖、分化など)も年齢とともに低下します。Wang と Nirmala は、老化により腱細胞幹細胞の特性と成長因子受容体の数が減少すると報告しました。動物実験では、若い馬の PDGF 濃度が高いことが示されました。彼らは、若年者のGF受容体の数とGFの数の増加により、PRP治療に対する細胞反応が高齢者の若年者よりも優れている可能性があると結論付けました。これらの研究結果は、幹細胞が少なく「品質が悪い」高齢患者では、PRP治療がなぜ効果が低いか、効果がないのかを明らかにしています。PRP注射後、老化した軟骨の老化プロセスが逆転し、軟骨細胞の休止期間が増加することが証明されています。ジアら。これは、PRP 処理の有無にかかわらずマウス皮膚線維芽細胞の in vitro 光老化を研究し、このモデルにおける PGF の反作用のメカニズムを明らかにするために使用されます。PRP グループは細胞外マトリックスに直接的な効果を示し、I 型コラーゲンを増加させ、メタロプロテイナーゼの合成を減少させました。これは、PRP が細胞の老化に対抗し、変性 MSK 疾患にも対抗できることを示しています。
別の研究では、PRP を使用して老化したマウスから老化した骨髄幹細胞を収集しました。PRPは、細胞増殖やコロニー形成など、老化から幹細胞のさまざまな機能を回復し、細胞の老化に関連するマーカーを再構築できることが判明しています。
最近、Oberlohr らは、筋肉再生の弱体化における細胞老化の役割を広範囲に研究し、骨格筋修復のための生物学的治療の選択肢として PRP と乏血小板血漿 (PPP) を評価しました。彼らは、骨格筋修復のための PRP または PPP 治療が、SASP 特異的細胞マーカーおよび線維症の発症につながるその他の因子に合わせてカスタマイズされた生物学的因子に基づいていることを構想しました。
PRP を適用する前に、標的細胞老化により局所 SASP 因子を減少させることにより生物学的治療効果の再生特性を改善できると考えるのが合理的です。骨格筋再生のための PRP および PPP 治療の結果を改善する別のオプションは、老化スカベンジャーを使用して老化細胞を選択的に除去することであることが示唆されています。細胞の老化や老化に対するPRPの効果に関する最近の研究結果が興味深いものであることは間違いありませんが、まだ初期段階にあります。したがって、現時点で何らかの提案をすることは不合理です。
(本記事の内容は転載であり、当社は本記事に含まれる内容の正確性、信頼性、完全性について明示的、黙示的を問わずいかなる保証も行うものではなく、また本記事の見解については責任を負いません、ご了承ください。)
投稿時間: 2023 年 3 月 1 日